Säurestärke
Säurestärke
Die Stärke einer Säure kann durch den 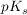 beziehungsweise beziehungsweise 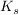 angegeben werden. Die Konzentration einer bestimmten Komponente wird im folgenden immer in eckigen Klammern geschrieben. angegeben werden. Die Konzentration einer bestimmten Komponente wird im folgenden immer in eckigen Klammern geschrieben.
Wird eine Säure HA in Wasser 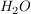 gegebn, so dissoziiert diese zu gegebn, so dissoziiert diese zu 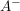 und und  beziehungsweise beziehungsweise 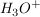 . Diese Reaktion kann als Gleichgewicht mit der Gleichgewichtskonstanten K aufgefasst werden. . Diese Reaktion kann als Gleichgewicht mit der Gleichgewichtskonstanten K aufgefasst werden.
Wird von einer wässrigen Lösung ausgegangen, so ist ![$ [H_2O]\approx konstant $ $ [H_2O]\approx konstant $](/teximg/4/3/01448934.png) und die Wasserkonzentration kann mit in die Gleichgewichtskonstante hineingezogen werden kann und dann und die Wasserkonzentration kann mit in die Gleichgewichtskonstante hineingezogen werden kann und dann 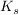 genannt wird. genannt wird.
Da der 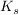 -Wert oft recht unhandlich ist wurde der -Wert oft recht unhandlich ist wurde der 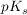 -Wert eingeführt. Dieser kann analog zum pH-Wert formuliert werden. -Wert eingeführt. Dieser kann analog zum pH-Wert formuliert werden.
| 